生体情報システム科学専攻 Major of Biological Information Systems
オルガネラ合成生物学
Organelle synthetic biology
Organelle synthetic biology
 細胞生物学 Cell biology
細胞生物学 Cell biology小池 誠一 Seiichi Koike
- TEL : 076-445-6835
- URL : https://researchmap.jp/sekoike
- Keywords : Organelles, Microinjection, Synthetic biology, Membrane, Membrane traffic
研究の背景と目的 Background and Purpose of Study
近年の分子生物学的手法や網羅的解析法の発達によって、細胞を構成するタンパク質や核酸などの「部品」の理解が急激に進んだ。しかし、それらの部品をプラモデルのように組み合わせても、私たちには新しい「生命」を作り出すことは出来ない。それは、タンパク質や脂質の集合体である細胞内機能ユニットであるオルガネラ、そしてそれらオルガネラが織りなす複雑なネットワークについての理解が足りないからと考えられる。細胞の基本原理を理解し、その破綻によって引き起こされる様々な疾患を理解・治療して行くためには、私たちは、これまで以上にオルガネラに注目して研究を行っていく必要がある。しかしこれまでの分子生物学的手法ではオルガネラ自体を操作することが不可能であった。そこで私たちは、オルガネラ量を増減させたり、人工オルガネラを細胞内で新規に構築する方法を開発するとともに、それらの手法を用いることによってオルガネラの隠された一面を理解すべく研究を行っている。この新しい”オルガネラ合成生物学”を通して、”細胞”の理解、更には”生命”の理解に少しでも貢献していきたい。Molecular biology brings us many knowledge about proteins and DNA, which are the "components" making up cells. However, even if these components are combined each other, we cannot create a new "life" so far. In order to understand the basic principles of cells, and to treat various diseases caused by cellular functions, we have to understand organelles, which are intracellular functional units composed of proteins, lipids and so on. Therefore, we would like to develop new methods for manipulating organelles, which has not been possible with conventional molecular biology techniques, and we use these techniques to discover new aspects of organelles.
本研究の領域横断性
本研究の最終目的は細胞機能の理解を目指すものである。そのために一般的な細胞生物学研究で用いられている分子生物学的手法、生化学的手法などを主に用いて研究を行って行く。更に、人工オルガネラを作成するために、リポソームを用いた研究、更に工学的視点から作られたナノマシーンを細胞内に持つハイブリッド細胞の作成に挑戦する。よって、生物物理学、工学的手法も取り入れる。また、オルガネラ機能の破綻によって引き起こされる疾患の治療に向けて、医学・薬学研究者とも共同研究を行う。研究内容
研究1:小胞輸送に必要十分な「宛先」情報を明らかにする
細胞内では無数の輸送小胞が盛んに行き来しており、オルガネラ間での物質輸送を担っている。私は輸送小胞がどのように正しい「行き先」(標的オルガネラ)を見つけるのかに興味を持って研究を行ってきた。既に分子生物学的手法を用いて膜輸送に関わる多くの因子が同定されているが、これらの情報だけでは「宛先」情報の十分条件を明らかにすることは出来なかった。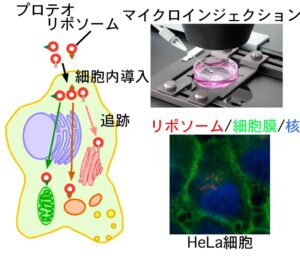 そこでリポソームを用いて特異的なターゲティング機構を備えた人工輸送小胞を作成することでこの問題に挑戦した。それまでにオルガネラやリポソームなどの超分子複合体を細胞内に効率的に導入する方法が確立されていなかったことから、まずこれら超分子複合体をマイクロインジェクションによって低侵襲に細胞内に導入する方法を確立した。この方法を用いて細胞外で作成した人工輸送小胞を細胞内に導入することで、細胞内で輸送小胞が正しいターゲット(オルガネラ)まで運ばれて行くための必要最小因子の同定を行なった。その結果、リポソーム膜上に特定のSANREタンパク質があれば、そのリポソームが細胞内に導入された後、特定のオルガネラへのみ運ばれること、更にオルガネラ膜上に存在する「係留因子」が目的のSANREを持つ小胞を捕獲することが、SNARE依存的な小胞輸送の特異性を決定していることがわかった。これまで、SNAREタンパク質は膜融合の過程で働くと理解されてきたが、係留過程でも重要な役割を担っていることを初めて明らかにすることができた。この成果は、輸送小胞が持つ「行き先」の必要十分条件を初めて明らかにしたものであり、今後輸送小胞の行先を人工的にコントロールするために非常に重要な知見である。現在は、オルガネラ膜に存在し特異的SNAREタンパク質と結合する新規係留因子の同定を試みている。すでに、Vps13Bを同定しており、現在はその詳細な機能について調べている。
そこでリポソームを用いて特異的なターゲティング機構を備えた人工輸送小胞を作成することでこの問題に挑戦した。それまでにオルガネラやリポソームなどの超分子複合体を細胞内に効率的に導入する方法が確立されていなかったことから、まずこれら超分子複合体をマイクロインジェクションによって低侵襲に細胞内に導入する方法を確立した。この方法を用いて細胞外で作成した人工輸送小胞を細胞内に導入することで、細胞内で輸送小胞が正しいターゲット(オルガネラ)まで運ばれて行くための必要最小因子の同定を行なった。その結果、リポソーム膜上に特定のSANREタンパク質があれば、そのリポソームが細胞内に導入された後、特定のオルガネラへのみ運ばれること、更にオルガネラ膜上に存在する「係留因子」が目的のSANREを持つ小胞を捕獲することが、SNARE依存的な小胞輸送の特異性を決定していることがわかった。これまで、SNAREタンパク質は膜融合の過程で働くと理解されてきたが、係留過程でも重要な役割を担っていることを初めて明らかにすることができた。この成果は、輸送小胞が持つ「行き先」の必要十分条件を初めて明らかにしたものであり、今後輸送小胞の行先を人工的にコントロールするために非常に重要な知見である。現在は、オルガネラ膜に存在し特異的SNAREタンパク質と結合する新規係留因子の同定を試みている。すでに、Vps13Bを同定しており、現在はその詳細な機能について調べている。
研究2:どのようにしてオルガネラの量が一定に保たれるのか?
1つの細胞が分裂し2つの娘細胞ができてもオルガネラの配置、数はほとんど同じである。このことは、細胞はオルガネラの数や位置を厳密に制御していることを意味している。これまでのアプローチのみでは、オルガネラの「量」を意図的に変化させることは難しく、細胞がオルガネラの量を制御するメカニズムや、その生理的意義は明らかになっていない。そこで、オルガネラの量を人為的に変化させるシステムを開発することで、オルガネラ量を感知するセンサー機構の解明とその生理的意義を明らかにする。
参考文献
- Koike S, Jahn R. SNAREs define targeting specificity of trafficking vesicles by combinational interaction with tethering factors.Nature Communications, (2019) 10, 1608 <Faculty of 1000に選ばれた>
- Saito M, Koike S, Holm K, Bregolin FL, Hofsäss H. External RBS/PIXE analysis for evaluating quantum dots internalization into HeLa cells Nucl. Instrum. Methods Phys. Res. Sect. B, (2019) 450, 173-178
- Koike S, Jahn R. Probing and manipulating intracellular membrane traffic by microinjection of artificial vesicles. Proc. Natl. Acad. Sci. USA (2017) 114, E9883-E9892
- Milovanovic D, Honigmann A, Koike S, Göttfert F, Pähler G, Junius M, Müllar S, Diederichsen U, Janshoff A, Grubmüller H, Risselada HJ, Eggeling C, Hell SW, van den Bogaart G, Jahn R. Hydrophobic mismatch sorts SNARE proteins into distinct membrane domains. Nature Communications, (2015) 6, 5984
- Kamijo H, Matsumura Y, Thumkeo D, Koike S, Masu M, Shimizu Y, Ishizaki T, Narumiya S. Impaired vascular remodeling in the yolk sac of embryos deficient in ROCK-I and ROCK II. Genes to Cells, (2012) 16, 1012-21.
- Koike S, Yutoh Y, Keino-Masu K, Noji S, Masu M, Ohuchi H. Autotaxin is required for the cranial neural tube closure and establishment of the midbrain-hindbrain boundary during mouse development. Dev. Dyn., (2011) 240, 413-21.
- Koike S, Keino-Masu K, Masu M. Deficiency of autotaxin/lysophospholipase D results in head cavity formation in mouse embryos through the LPA receptor-Rho-ROCK pathway. Biochem. Biophy. Res. Commun., (2010) 400, 66-71.
- Koike S, Keino-Masu K, Ohto T, Sugiyama F, Takahashi S, Masu M. Autotaxin/lysophospholipase D-mediated lysophosphatidic acid signaling is required to form distinctive large lysosomes in the visceral endoderm cells of mouse yolk sac. Biol. Chem., (2009) 284, 33561-70.<Nature Lipidomics Gatewayで取り上げられた><表紙を飾った>
- Koike S, Keino-Masu K, Ohto T, Masu M. The N-terminal hydrophobic sequence of autotaxin (ENPP2) functions as a signal peptide. Genes to Cells., (2006) 11, 133-42.
- Nagamine S, Koike S, Keino-Masu K, Masu M. Expression of a heparan sulfate remodeling enzyme, heparan sulfate 6-O-endosulfatase sulfatase FP2, in the rat nervous system. Brain Res. Dev. Brain Res., (2005) 159, 135-43.

