認知・情動脳科学専攻 Major of Cognitive and Emotional Neuroscience
Molecular and cellular mechanisms underlying memory formation
 分子脳科学 Molecular brain science
分子脳科学 Molecular brain science井ノ口 馨 Kaoru Inokuchi
- TEL : 076-434-7225
- URL : http://www.med.u-toyama.ac.jp/bmb/index-j.html
- Keywords : memory trace, engram, synaptic plasticity, gene expression, optogenetics, imaging
研究の背景と目的 Background and Purpose of Study
脳機能の研究は21世紀に残された科学研究の最後のフロンティアの一つである。ここ20年余りの研究の進展により、学習・記憶などの脳の高次機能を分子の言葉で理解することが現実のものとなってきた。脳機能の分子レベルでの理解は「人間とは何か、自分は何者であるのか」と云う哲学的命題に自然科学の視点から答えようとする営みであると共に、老化に伴う脳機能の低下や老人性の痴呆、さらには様々な精神疾患の予防・治療への道を拓くものとして期待されている。 脳の様々な機能の中でも、「記憶」は最も基礎的かつ重要なものの一つである。人間の精神の営みは記憶なしでは成り立ちえないし、認知症を見るまでもなく、自分が自分であることを認識する上で記憶の果たす重要性は明らかである。高齢化社会を迎える今後、「記憶」の仕組みを解明することは社会的な要請でもある。 当講座では、「記憶」の分子機構を明らかにすることを目標としている。「記憶」という巨大な象を理解するためには、鼻や足や胴体だけを触って「記憶とはホースのようなものだ」「いや柱のようなものだ」「いやいや壁のようなものだ」と言っていても始まらないわけで、あらゆる方向からのアプローチが必要だ。私たちは、「分子レベルでの理解」を合い言葉に、分子生物学・生化学から細胞生物学・組織化学・電気生理学・行動薬理学までの幅広いアプローチを取ることによって理解を深めようとしている。私たちの研究が、人間のより深い理解につながり、また、さまざまな脳機能障害や精神疾患の予防・治療につながることを願っている。
1) The hippocampus (HPC) is crucial for the formation of some types of declarative memories during the mnemonic process in humans. The recall of acquired memories is initially dependent on the HPC, but that HPC-dependency progressively decays over time, a process that is associated with a gradual increase in dependency upon an extra-hippocampal region, such as neocortex. In the hippocampal dentate gyrus (DG), new neurons are continuously generated in the subgranular zone (SGZ) throughout adulthood in many mammals. We hypothesized that hippocampal neurogenesis is involved in the gradual decay of hippocampal LTP and in the gradual decay of HPC-dependency of associative memory over time (30-day memory, remote memory). 2) A synaptic tag is a hypothetical mark present in synapses expressing early-phase plasticity, and allows plasticity-related proteins (PRPs) to function only in the tagged synapses, while its molecular identity remains elusive. We hypothesized that activity-dependent regulation of spine entry of the soma-derived PRPs serves as a synaptic tag.
研究内容
私たちは「長期記憶形成の分子・細胞メカニズム」について動物モデルを用いて研究を行っている。最近の主要な成果を二つ紹介する。
1)生後脳の神経新生と恐怖記憶の処理過程
ヒトを含む多くの動物種において、記憶獲得後、ある種の記憶の想起は、最初は海馬の働きを必要とするが、時間経過に伴い徐々にその海馬依存性が減少する。そして数週間後には海馬の働きを必要とせずに想起できるようになる、すなわち時間経過とともに記憶の依存する脳領域が移行する。しかし、どのような仕組みで記憶が海馬依存的な状態から海馬非依存的な状態へとなるのかについては、これまで分かっていなかった。 また興味深いことに、海馬では脳の発生が終了した大人においても、新しい神経細胞が絶え間なく生産され続けていることが、ヒト、サルを含む多くの動物種で分かっている。私たちは海馬における神経新生が記憶形成に果たす役割に着目し、物理的あるいは遺伝子改変技術によって海馬の神経新生が障害されたマウス、対照的に神経新生が促進されたマウスを用いて、恐怖記憶獲得後の記憶処理過程における神経新生の役割について検討した。 その結果、海馬における継続的な神経新生の程度に依存して、恐怖記憶が海馬依存的な状態から非依存的な状態へと移行する速度が抑制されたり、逆に加速されたりすることが明らかになった(Fig. 1)。
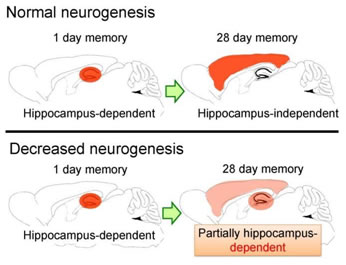
Fig. 1: Neurogenesis modulates hippocampus-dependence of fear memory.
この成果は、海馬の神経新生を適切に制御することによって、恐怖記憶を保存する脳領域をコントロールできる可能性を示唆している。 さらに私たちは、過去に恐怖体験した時の記憶が正しく海馬非依存的な状態とならずに海馬依存的な状態として維持されると、そのマウスのその後の新規環境における探索行動、不安行動に影響を及ぼすことを見出した。これは、トラウマ体験後の日常生活に支障をきたすPTSD患者の症状と類似している。 これらの結果は、ヒト PTSD 症状が長期的に持続してしまう原因、もしくはリスクファクターの1つが、生後の海馬の神経細胞の新生であることを示唆している。海馬の神経新生を適切に制御することで、恐怖記憶が保存される脳領域をコントロールでき、トラウマ記憶が原因となる PTSD の新たな予防法・治療法開発への展開が期待される。
2)シナプスタグ
神経細胞にはシナプスが1細胞当たり数千~数万個あり、他の神経細胞と情報のやり取りをしている。一つひとつの神経細胞は多くの記憶に関わっているが、記憶ごとに異なるシナプスを使い分けることで、個々の記憶を混同せずに正確に保存していると考えられている。 長期間保存される記憶では、その記憶に対応する特定のシナプスに細胞体から記憶関連たんぱく質が配達されることでそのシナプスの働きの変化が持続し、記憶が正しく長期間保存されると考えられる。ところが、1細胞あたり数多く存在するシナプスのうち、どのような仕組みで特定のシナプスのみに記憶関連たんぱく質を配達し、働かせているのかは分かっていなかった。これを説明するためにシナプスタグ仮説が提唱されているが、タグの実体が不明のうえ、本当にそういう仕組みがあるのか実証されていなかった。 私たちは、記憶関連たんぱく質 Vesl-1S に GFP を融合させることで、神経細胞内における記憶関連たんぱく質の局在を可視化した。この分子の挙動を解析した結果、記憶関連たんぱく質は細胞内全てに配達された後、その時に使用されていたシナプスだけに取り込まれることが明らかになり、仮説が正しいことが実証された。さらに、シナプスタグの実体は、シナプス後部のスパインの入り口にあるゲートの開閉であることを発見した(Fig. 2)。
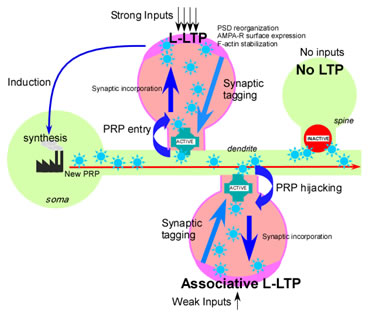
Fig. 2: Synaptic tag mechanism
参考文献
- Yokose J, Okubo-Suzuki R, Nomoto M, Ohkawa N, Nishizono H, Suzuki A, Matsuo M, Tsujimura S, Takahashi Y, Nagase M, Watabe AM, Sasahara M, Kato F, and Inokuchi K. Overlapping memory trace indispensable for linking, but not recalling, individual memories. Science, 355: 398-403 (2017). doi:10.1126/science.aal2690
- Nomoto M., Ohkawa N., Nishizono H., Yokose J., Suzuki A., Matsuo M., Tsujimura S., Takahashi Y., Nagase M., Watabe A.M., Kato F., and Inokuchi K. Cellular tagging as a neural network mechanism for behavioral tagging. Nature Communications, 7: 12319 (2016). doi:10.1038/ncomms12319
- Ohkawa N., Saitoh Y., Suzuki A., Tsujimura S., Murayama E., Kosugi S., Nishizono H., Matsuo M., Takahashi Y., Nagase M., Sugimura Y.K., Watabe A.M., Fusao Kato F., and Inokuchi K. Artificial Association of Pre-Stored Information to Generate a Qualitatively New Memory. Cell Reports, 11, 1-9 (2015). DOI: http://dx.doi.org/10.1016/j.celrep.2015.03.017
- Okada, D., Ozawa, F. & Inokuchi, K. Input-specific spine entry of soma-derived Vesl-1S protein conforms to synaptic tagging. Science (Research Article), 324, 904-909 (2009).
- Kitamura, T., Saitoh, Y., Takashima, N., Murayama, A., Niibori, Y., Ageta, H., Sekiguchi, M., Sugiyama, H. &Inokuchi, K. Adult neurogenesis modulates the hippocampus-dependent period of associative fear memory. Cell 139, 814-827 (2009).

